
4. Физиология контактных хеморецепторных сенсилл
Качественный диапазон каналов, по которым поступает информация через хеморецепторы у насекомых, крайне узок. Так, если в обонятельном эпителии кролика содержится около 100 млн. чувствительных клеток, то у гусеницы бражника всего 48. Вместе с тем в способности распознавать пищевые субстраты по запаху насекомые не уступают высшим животным. Выбор пищи у мухи Phormia regina обеспечивается функционированием лишь 250 ла-беллярных волосков и 65 папилл на хоботке.
Малочисленность чувствующих клеток в воспринимающей системе неизбежно приводит к увеличению специализации отдельных ее элементов. Хеморецепторные органы насекомых отличаются от позвоночных более высокой специфичностью рецепторных клеток. Вместе с тем нельзя предполагать, что насекомые живут в мире альтернативных химических сигналов. Поскольку синаптические контакты у насекомых не найдены ни на периферии, ни в афферентных путях, у них, по-видимому, отсутствует предварительная интеграция сигнала, а первичный анализ импульсной активности осуществляют нервные центры, и они же формируют ответ на предъявленный химический стимул.
Пороги и чувствительность
Первые результаты по определению чувствительности контактных хеморецепторов, процессов суммации, адаптации, зависимости ответов от качества раздражающего стимула и т.д. были получены путем изучения поведения насекомых или простейших движений их конечностей, хоботка, околоротовых придатков при раздражении сенсилл растворами и чистыми веществами.
Результаты сопоставления вкусовой чувствительности насекомых и человека показывают, что на широкий круг химических oсоединений она измеряется примерно одними и теми же величинами. Так, человек ощущает вкус сахара при концентрации 0,02 М, а пчела отличает раствор этого вещества от дистиллированной воды при концентрации 0,06 М. Слепень Tabanus положительно реагирует на растворы сахарозы в концентрациях 0,005-0,11 М. Однако многие бабочки вытягивают хоботок при контакте раствора сахарозы с тарзусом, когда концентрация раствора равна 0,00001 М.
Хеморецепторы, расположенные на тарзусе и лабеллах одного и того же вида насекомых, имеют разную величину порога реакции на растворы вкусовых веществ. Пороговая концентрация сахарозы, необходимая для возникновения рефлекторной пищевой реакции мухи Phormia regina, равна 0,0098 М, если раствор наносить на тарзальные волоски. При раздражении лабеллярных волосков положительный ответ возникает на 0,0001 М концентрацию сахарозы.
У мух Calliphora наблюдаются обратные отношения: тарзальные рецепторы в шесть раз более чувствительны к раствору сахара, чем лабеллярные. У пчел, собирающих сладкий нектар, вкусовые рецепторы хоботка малочувствительны к сахару. Пороговая концентрация для лабеллярных рецепторов равна 0,125-0,062 М, в то время как контактные хеморецепторы антенн воспринимают раствор сахарозы в концентрации 0,07-0,01 М. Малая чувствительность лабеллярных рецепторов у насекомых, питающихся растворами углеводов, биологически оправдана, так как насекомые должны поглощать при питании более концентрированные растворы Сахаров.

Таблица 4 Пороговые концентрации вкусовых веществ для человека и пчелы, М. (по Редеру. 1963)
Для веществ, которые вызывают у насекомых отрицательную пищевую реакцию, или реакцию отвергания (хлористый натрий, соляная кислота, хинин), установлены пороговые значения концентраций, близкие к тем, которые наблюдаются у человека. Так, человек начинает отличать раствор хлористого натрия от дистиллированной воды при концентрации 0,09 М, пчела - при 0,24 М, слепни Tabanus sp. - при 0,8 M, мухи Phorrnia regina - при 0,58 М. Пороговые концентрации кислоты, хинина и сахарозы для пчел и человека имеют величину одного и того же порядка (табл. 4).
Однако к этим данным следует относиться с определенной осторожностью, поскольку в качестве критериев использовались не ответы хеморецепторов насекомых, а рефлекторные реакции всего организма или отдельного органа в ответ на химическую стимуляцию. Даже в случае раздражения отдельной хеморецепторной сенсиллы на хоботке или лапке насекомого следует учитывать физиологическое состояние насекомого, определяющее порог рефлекторной реакции.
Электрофизиологические исследования
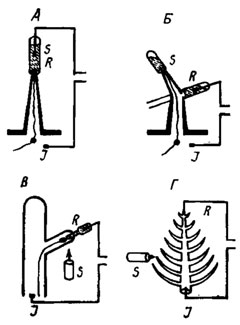
Рис. 29. Способы регистрации биопотенциалов хеморецепторных сенсилл насекомых (по Hodgson, 1964): А - регистрация микропипеткой от кончика волоска контактной хеморецепторной сенсиллы; Б - регистрация через отверстие в стенке волоска; В - регистрация микроэлектродом через кутикулярную стенку придатка; Г - регистрация суммарного потенциала от целого придатка - антенны. S - раздражитель; R - активный электрод; I - индифферентный электрод
В 1954 г. американскими физиологами Е. Ходжсоном и К. Редером была предложена методика регистрации биоэлектрической активности контактных хеморецепторных сенсилл, используемая и в настоящее время (рис. 29). В опыте тонкая пипетка (диаметром 10-20 мкм) заполнялась раствором электролита и служила активным электродом. Если в ткани тела или головы насекомого ввести другой, индифферентный электрод и привести пипетку в контакт с кончиком волоска, то можно зарегистрировать импульсы, отражающие активность чувствующих клеток сенсиллы. Контактным химическим раздражителем в данном случае будет электролит, заполняющий пипетку. Подобный метод не применим для неэлектролитов. Для раздражения сенсиллы неэлектролитами, растворимыми в воде, например различными сахарами, в качестве растворителя для раздражающего вещества используют либо крайне слабый раствор хлористого натрия, либо раствор электролита, нейтрального для хеморецепторных клеток. Иногда регистрируют потенциалы через отверстие в стенке волоска, из полости сенсиллы, куда микроэлектрод вводят через сочленовную мембрану (рис. 29). Во всех случаях потенциалы чувствующих клеток соседних сенсилл обычно не регистрируются, так как клетки данной сенсиллы отделены базальной мембраной от полости тела и от чувствительных клеток других сенсилл. Импульсы в ответах контактной хеморецепторной сенсиллы можно разделить на несколько типов по величине их амплитуды. Каждая из амплитуд соответствует активности одной из чувствующих клеток.
При раздражении контактных хеморецепторных сенсилл растворами хлористого натрия или других солей в концентрации 0,1-0,5 М регистрируется залп одинаковых по амплитуде (около 1 мВ) и форме импульсов, отражающих активность чувствующей клетки, специфичной к растворам электролитов. Эту клетку обозначают как солевой, или L-рецептор. Другая клетка в сенсилле возбуждается при раздражениях растворами глюкозы, сахарозы и других углеводов, потребляемых насекомыми в пищу, и называется сахарным, или S-рецептором. Его импульсы несколько меньше по амплитуде, чем импульсы L-рецептора, когда они регистрируются одновременно. В кончике волоска расположено окончание дендрита третьей клетки, которую часто называют водным, или W-рецептором. Ее возбуждение происходит при действии на сенсиллу чистой воды.
Результаты последних исследований говорят о том, что солевые рецепторы (L) можно разделить на две группы: анионные (L1) и катионные (L2). Они вызывают реакцию отвергания у мух, неиспытывающих чувства жажды. Когда же мухи находятся долгое время без воды, раздражение катионного рецептора вызывает положительную пищевую реакцию, в то время как раздражение анионного соответствует реакции отвергания.
Если во время регистрации импульсов в ответ на раздражение растворами сахара или соли согнуть волосок при помощи раздражающей пипетки, то можно зарегистрировать импульсы небольшой амплитуды. Они отражают активность M-рецептора - механо-рецепторной клетки, которая присутствует в сенсилле совместно с хеморецепторными (L1, L2, S, W) клетками.
Одна из особенностей импульсов, регистрируемых по методике Е. Ходжсона и К. Редера при помощи микропипетки, заключается в их положительной полярности. Причину этого явления объяснили результаты одновременной регистрации биопотенциалов на различных уровнях длинного (100-200 мкм) лабеллярного волоска мухи Phortnia regina. Дендритный холмик, где возникает импульс, отстоит достаточно далеко от места регистрации. В момент появления импульса в основании дендрита, где мембрана становится негативной, в кончике волоска возникает положительное отклонение потенциала. Импульс распространяется по двум направлениям: к центральной нервной системе по аксону клетки и к кончику волоска по ее дендриту. Когда импульс достигает верхушки волоска, положительная фаза переходит в отрицательную фазу.
Регистрация активности хеморецепторных клеток во вкусовой папилле у мухи Phormia regina показала несколько иную картину. В то время как импульсы сахарного рецептора имеют положительную полярность, импульсы солевого рецептора, зарегистрированные в тех же условиях, имеют отрицательную полярность. Подобные результаты были получены и в опытах при отведении биопотенциалов от маленьких (30-40 мкм) хеморецепторных волосков на хоботке комара Aedes aegypti, где импульсы L-рецептора характеризуются отрицательным знаком отклонения потенциала, а импульсы S-рецептора - положительным.
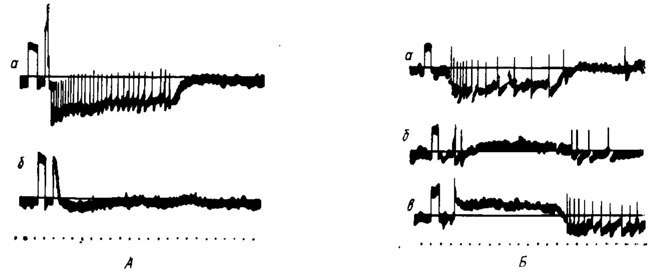
Рис. 30. Ответы контактной хеморецепторной сенсиллы на лабеллуме мухи Calliphora (no Morita, Yamashita, 1959): А - на раздражение 0,25-молярным раствором сахарозы до (а) и после (б) отравления; Б - на раздражение 0,25-молярным раствором сахарозы (а), смесью 0,25-молярного раствора сахарозы и 0,05-молярного раствора СаС12 (б) и 0,05-молярным раствором СаС12 (в). Отметка времени - 20 мс
Генераторный потенциал хеморецепторной клетки представляет собой медленное отрицательное колебание с амплитудой в несколько милливольт, быстро возрастающее в момент начала действия раздражителя и поддерживающееся на постоянном уровне в течение всего времени его действия. На фоне генераторного потенциала регистрируются импульсы положительной полярности с частотой, снижающейся по мере действия раздражителя (рис. 30,А). При раздражении хеморецептора хлористым калием и гуанином генераторный потенциал приобретает обратный знак, рецепторная мембрана гиперполяризуется, и импульсы исчезают (рис. 30,Б). При раздражении сенсиллы смесью веществ, возбуждающей несколько рецепторных клеток, регистрируется суммарный генераторный потенциал.
Свойства солевого рецептора
Е. Ходжсоном и К. Редером в 1954 г. на лабеллярных хеморецепторах мухи Phormia regina было установлено, что интенсивность стимула зависит в основном от вида катиона и в меньшей степени от аниона молекулы. Эффективность раздражающего раствора пропорциональна ионной подвижности химических веществ. Видимо, на рецепторной поверхности солевого рецептора существуют отрицательные (анионные) заряды, вступающие в связь с катионами раздражителя. Связь устанавливается чрезвычайно быстро, так как латентный период возбуждения рецептора очень мал и составляет несколько миллисекунд. Отсутствие температурного эффекта и эффекта рН (в диапазоне рН 3-11) в реакции солевого рецептора на раздражитель позволяет предположить, что взаимодействие между катионами раздражителя и мембранными акцепторами солевого рецептора носит физический характер и не включает энзимохимические реакции.
Сравнение функций солевого рецептора мухи с реагирующей на соль рецепторной клеткой крысы позволило сделать вывод, что катионы реагируют с некоторым акцептором мембраны и величина ответа прямо пропорциональна числу ионов, вступающих с ним в реакцию. Как и у позвоночных животных, ответы солевого рецептора в сенсиллах насекомых подчиняются теории Л. Бейдлера (1954), основное уравнение которой имеет следующий вид:
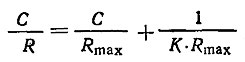
где С - концентрация стимула;
R - величина ответа клетки при данной концентрации;
Rmax - величина ответа, когда заняты все участки акцептора;
К - константа равновесия. Все параметры этого уравнения, кроме константы равновесия (К), были получены экспериментально.
При этом графическое выражение зависимости 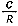 от С представляет собой прямую линию.
от С представляет собой прямую линию.
Константа равновесия служит мерой сродства раздражителя с рецептором. Небольшие величины найденных констант равновесия подтвердили предположение об адсорбции раздражителя на мембране чувствительной клетки и неферментативной природе реакции.
Л. Бейдлер, а вслед за ним Д. Эванс и Д. Меллон, проверявшие его теорию в 1962 г. на вкусовых рецепторах мухи, считают, что акцепторами, или активными участками мембраны, являются полиэлектролиты, имеющие заряженные боковые цепи, и предполагают, что в основе комплекса "стимул - акцептор" лежит образование водородных связей между катионами стимула и функциональными группами акцептора с отрицательным зарядом.
Несколько иных представлений о механизме восприятия раздражителя солевым рецептором насекомых придерживается английский физиолог К. Рис (1968). В основе его теории лежит предположение о наличии в мембране хеморецептора пор, внутренняя поверхность которых имеет фиксированные отрицательные заряды, в результате чего мембрана имеет отноcительную проницаемость к различным ионам.
Экспериментальное исследование зависимости между электрофизиологическим ответом солевого рецептора и физико-химическими параметрами молекул раздражителя - ионной активностью и ионным радиусом катионов и анионов солей - дало положительную корреляцию. Однако она наблюдается только в том случае, когда величина диаметра ионов рассчитывается без учета их гидратации. Теория К. Риса, в отличие от теории Л. Бейдлера, дает объяснение процессам адаптации, наступающей в рецепторе при длительном действии раздражающего стимула. В момент раздражения происходит быстрое возрастание концентрации ионов в жидкости, омывающей окончания периферических отростков чувствующих клеток. Это приводит к адсорбции положительно заряженных ионов на порах мембраны, что повышает ее сопротивление и приводит к уменьшению деполяризационного потенциала. Последнее вызывает падение частоты импульсов, соответствующее процессу адаптации рецептора.
Другая теория возбуждения хеморецепторов, в которой возникновение возбуждения солевого рецептора обусловливается изменением проницаемости клеточной мембраны под действием стимула, была выдвинута в 1972 г. К. Оттером. Клеточная мембрана рецептора рассматривается как каркас из бимолекулярного слоя фосфолипидов, в котором липидные молекулы расположены перпендикулярно к плоскости мембраны гидрофильными группами наружу. Кроме того, в мембране могут присутствовать глобулярные и спиральные молекулы протеинов, и изменение проницаемости мембраны вкусовых клеток для ионов, наступающее во время стимуляции, происходит в результате открытия и запирания "организованных" и "статистических" пор. "Организованные" поры могут быть образованы спиральными сегментами пептидов, стабилизированных гидрофобными посредниками с липидами мембран. Знак заряда внутреннего пространства пор находится в зависимости от последовательности аминокислот в цепочках пептидов. "Статистические" поры появляются в результате теплового движения молекул мембраны, плотность "упаковки" которых определяет число пор. Ионы Са++ связывают молекулы мембраны путем формирования звеньев между анионными участками.
При раздражении рецептора хлоридами щелочных металло - ионы Сl- связывают ионы Са++ и тем самым ослабляют "упаковку" молекул мембраны, что ведет к ослаблению проницаемости. Этому процессу противодействует фиксация щелочных катионов на фосфатных группах молекул мембраны, которая определяется сродством катионов к фосфатным группам. Подобными механизмами К. Оттер объясняет ответы вкусовой клетки на раздражение неорганическими солями аммония, солями щелочных и щелочноземельных металлов. Действие растворенных в воде органических раздражителей зависит от адсорбционных свойств молекул раздражающего вещества и от их распределения в системе вода - липидный слой и внутри двухслойной мембраны.
Свойства сахарного рецептора
Экспериментальные данные, полученные Е. Ходжеcоном в электрофизиологических опытах на мухе и при изучении поведенческих реакций, показали, что изомерия молекул Сахаров является одним из основных качеств молекул, определяющих стимулирующий эффект. Так, D-арабиноза оказалась более сильным раздражителем, чем L-арабиноза. Однако стимулирующая эффективность Сахаров, спиртов, кислот и других органических соединений зависит не только от стереоизомерии, но и от степени растворимости, атомного веса, разветвленности молекулярной цепочки, пространственной структуры молекулы.
В настоящее время считают, что на рецепторной мембране даже одной чувствующей клетки - сахарного рецептора - есть несколько типов так называемых "рецепторных участков", которые вступают в связь с молекулами раздражителя. "Рецепторные участки" для глюкозы соединяются с гидроксильными группами молекулы. Другие соединения также будут действовать на эти участки, если наклон их гидроксильных групп к основной плоскости молекулы колеблется в пределах ±19°.
В водных растворах сахара обычно присутствуют в виде 5-6-членных колец - фуранозных или пиранозных группировок. Голландский энтомолог Л. Шоонховен в 1974 г., после проведения испытаний большой группы полигидроксильных соединений, образующих 6-членные кольца, предположил, что наибольшим стимулирующим действием для контактных рецепторов клеток, локализованных в медиальных стилоконических сенсиллах гусеницы Dendrolimus pint, обладают вещества с определенным расположением гидроксильных групп:
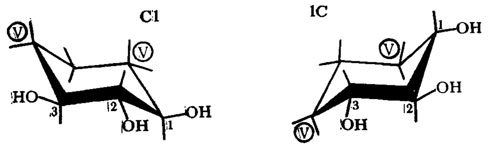
Три экваториальные гидроксильные группы пиранозного кольца (1, 2, 3) не должны быть стерически изолированы другими группами или радикалами соседних атомов углерода (V). Стерическая доступность данных трех функциональных групп обеспечивает их взаимодействие с соответствующими акцепторами на мембране сахарного рецептора. Конформационные изменения формы молекулы в конфигурации "кресла" (Сl-lС) не влияют на эффективность действия раздражителя на рецепторную клетку.
Регистрация биоэлектрической активности рецепторов медиальной стилоконической сенсиллы гусеницы Denarolimus pini показала правильность такого предположения (табл. 5).

Таблица 5 Эффективность стимулирующего действия циклических шестичленных углеводов для контактных хеморецепторов гусеницы Dendrolimus pini (по Шоонховену, 1974)
(Примечание. Эффективность оценивается по частоте афферентной импульсации (указана в скобках), имп/с.)
Рассматривая сахарный рецептор как систему, продуцирующую потенциалы действия, и используя кумулятивные графики, отражающие процесс накопления импульсов во времени, Л. Шоонховен обнаружил определенную аналогию между кумулятивными графиками, отражающими процессы адаптации рецептора, и кривыми, отражающими зависимость скорости ферментативной реакции от концентрации субстрата. Для обработки материала было использовано уравнение Михаэлиса-Ментен:
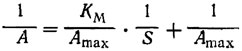
где S - концентрация стимула;
А - ответ рецептора на данную концентрацию; Amах - ответ на концентрацию, вызывающую максимальную реакцию рецептора; Км- константа Михаэлиса.
Как и в случае уравнения Я. Бейдлера, наблюдается линейная зависимость импульсного ответа рецептора от молярной концентрации раздражителя. Константа Михаэлиса в данном случае отражает сродство молекул раздражителя к акцепторам рецепторной мембраны сахарного рецептора. Эффективность веществ, раздражающих контактные хеморецепторы медиальной стилоконической сенсиллы гусеницы Dendrolimus pini, вычисленная по константе Михаэлиса, уменьшается в следующей последовательности: мезо-инозитол >βD-глюкоза >βD-ксилоза >σ-лактон D-глюконовой кислоты.
Многочисленные поведенческие и электрофизиологические исследования контактных хеморецепторов мух показали, что на стимулирующую активность молекул Сахаров большое влияие оказывает их оптическая изомерия. В 1972 г. японские физиологи X. Морита и другие, сопоставляя экспериментальные данные с теоретическими расчетами, детально изучили сродство молекул стимула к рецепторным мембранам, влияние положения отдельных активных центров в молекулах α- и β-глюкозы и их производных на стимулирующую активность: положение ОН-группы, наличие и положение полярных и неполярных групп - метильной, этильной, n-нитрофенильной.
Еще в ранних работах Э. Эванс (1963) предположил, что хеморецепторная мембрана сахарного рецептора имеет два акцепторных участка различного типа, один из которых вступает во взаимодействие с молекулой глюкозы, другой - с молекулой фруктозы. Дисахарид сахароза соединяется с "фруктозным" участком. Дальнейшее развитие представлений о возбуждении сахарного рецептора было проделано X. Морита и А. Шираиши в 1968 г. Эти авторы теоретически проанализировали предположение Эванса и пришли к заключению, что оно верно при действии типа сахарозы, когда образуется комплекс 1:1 - "рецепторный участок": дисахарид. В случае моносахаридов необходимо образование другого комплекса - 2:1, когда две молекулы стимула одновременно связываются одним рецепторным участком. Поэтому авторы предложили модель "рецепторного участка", состоящего из двух субъединиц. Возбуждение возникает, если один "рецепторный участок" одновременно занимают две молекулы моносахаридов или одна молекула дисахарида. В наибольшей степени для объяснения функционирования такого "рецепторного участка", состоящего из двух субъединиц, соответствует аллостерическая макромолекула.
Это объясняется двумя причинами. Во-первых, только макро-молекулярная структура может обеспечить специфическое восприятие Сахаров; во-вторых, незаряженные молекулы сахара могут вызвать электрические изменения в рецепторной мембране только посредством конформационных изменений рецепторного участка, и эти изменения могут быть связаны с аллостерическим переходом.
Первым экспериментальным подтверждением гипотезы о существовании вкусового рецепторного белка было выделение Ф. Дастоли и С. Прайсом в 1966 г. "сладкочувствительного" и "горько-чувствительного" белков из языка быка. В последние годы был сделан ряд попыток выделить аналогичный белок из сахарного рецептора насекомых. На основании некоторого параллелизма констант Михаэлиса для α-глюкозидазы и величины поведенческого порога для сахарного рецептора мух было сделано предположение, что этот фермент может быть рецепторным протеином для Сахаров. Позже многие исследователи обнаружили независимо, друг от друга α-глюкозидазу в экстрактах лабеллума и ног мух. Было установлено, что этот фермент имеет три изозима: Р1, Р2, РЗ, причем Р2 обладает наибольшим сродством к ряду Сахаров. Недавно α-глюкозидазная активность была обнаружена на вершине хеморецепторного волоска мухи. Константа Михаэлиса этого фермента находилась в соответствии с таковой изозима Р2 в препаратах лабеллума и ног мух.
Таким образом, имеются данные, позволяющие рассматривать изозим Р2 α-глюкозидазы как наиболее вероятный акцептор для сахарного рецепторного комплекса в хеморецепторных сенсиллах мух.
Факторы, влияющие на чувствительность
Эндогенные факторы. Работа хеморецепторных органов существенно зависит от физиологического состояния организма насекомого. Под термином "физиологическое состояние" обычно обозначают весь сложный комплекс изменений внутренней среды организма, соответствующий стадиям развития, возрасту, функционированию пищеварительного тракта, репродуктивным процессам и т. д.
Давно известно, что чувствительность насекомых к таким химическим раздражителям, как сахара, изменяется в зависимости от возраста или степени насыщенности насекомого пищей или водой. Ответы контактных хеморецепторных клеток мухи Phortnia regina зависят от возраста насекомого, степени его насыщения и некоторых генетических факторов. Е. Ходжсон утверждает, что некоторые нейросекреторные гормоны повышают чувствительность хеморецепторов насекомых.
При отведении биопотенциалов от лабеллярных хеморецепторных сенсилл у самок комаров Aedes aegypti в ответ на раздражение 0,2 М раствором хлористого калия и сахарозы оказалось, что максимальная частота импульсов в ответе как при раздражении хлористым калием, так и при раздражении сахарозой наблюдается в течение первых суток после выхода комаров из куколки. Затем интенсивность ответов снижается и становится минимальной на шестые-седьмые сутки, т. е. сразу же после первого кровососания. Постепенно незначительное увеличение ответов сменяется еще более глубоким снижением их интенсивности на десятые-тринадцатые сутки, во время их первой яйцекладки. Через некоторое время интенсивность ответов вновь возрастает.
Кровососание, развитие яиц и последующая яйцекладка сопровождаются значительными перестройками в гормональном составе крови самок комаров. Все эти данные говорят о том, что в колебаниях чувствительности организма насекомого к химическим стимулам при разных физиологических состояниях немалую роль играют изменения чувствительности самих рецепторных клеток. Очевидно, наряду с прямой нервной регуляцией чувствительности рецепторов важное значение здесь играет состояние внутренней среды организма, проявляющееся через гормональную регуляцию рецепторов.
Экзогенные факторы. В настоящее время внимание многих исследователей обращено на решение вопроса о взаимодействии между специфическими чувствующими клетками в хеморецепторных сенсиллах насекомых при раздражении их несколькими раздражителями одновременно. Наряду с установлением факта специфической чувствительности L-, S-, W- и М-рецепторов к раздражению соответственно моновалентными солями, сахарами, водой и механической стимуляцией имеются данные, которые указывают, что эта специфичность относительна.
Во-первых, на ответы хеморецепторных клеток действует такой фактор, как температура. Сами хеморецепторы не отвечают на непосредственное действие тепла или холода, но частота импульсов в афферентном залпе L- и S-рецепторов в ответ на раздражение солью или сахаром резко изменяется при изменении температуры всего препарата. Вместе с тем изменение температуры раздражающего раствора, охлаждение или согревание кончика волоска не влияют на ответ. Так, колебания температуры раствора от 2 до 41° не изменяют величины пороговой концентрации раздражителя при регистрации рефлекторных реакций и частоту импульсов в афферентном залпе сенсиллы. Проведенные опыты показали, что температурный эффект проявляется на уровне тел хеморецепторных клеток, где генерируются импульсы.
Во-вторых, механические раздражители, например качание волоска, не только возбуждают М-рецептор, но и в определенной степени влияют на 5- и L-рецепторы. Среди лабеллярных волосков мухи Lucilia sericata встречаются такие, где приложение механического стимула в течение первой минуты действия химического раздражителя вызывает увеличение частоты S- и L-рецепторов. Адаптированные к химическим стимулам S- и L-рецепторы не отвечают на механическое раздражение. Однако пока еще не представлено прямых доказательств того, что механические раздражения, вызывающие ответ S- и L-рецепторов, не являются для них неспецифическим раздражением.
Действие смеси раздражителей
Давно известно, что смесь веществ, например хлористого натрия и глюкозы, вызывает в специфических рецепторах ответ меньшей интенсивности, чем раздражение этими же веществами в тех же концентрациях в отдельности. Показано, что добавление к раствору хлористого натрия таких веществ, как СаСl2, MgCl2, Vo2(N03)2, HgCl2, FeCl2, BaCl2, этилового спирта, маннозы и сахарозы, тормозит реакцию L-рецептора, а добавление к раствору - сахарозы NaCl, СаСl2, FeCl2, HgCl2, холинхлорида, уксусной кислоты и октиламина тормозит реакцию S-рецептора.
Среди этих веществ можно выделить октиламин, который не оказывает раздражающего влияния ни на какую из рецепторных клеток сенсиллы, а тормозит как S-, так и L-рецепторы. Степень торможения зависит от концентрации октиламина. Раздражение раствором СаС12 лабеллярных трихоидных хеморецепторов у мухи Calliphora vomitporia также вызывает торможение S- и L-рецепторов. Знак генераторного потенциала при этом становится положительным, т. е. рецепторная мембрана гиперполяризуется. Однако, если раздражать раствором СаСl2 интерпсевдотрахеальную папиллу - вкусовые органы на оральном диске мухи Phormia regina, то можно зарегистрировать афферентные залпы импульсов. Очевидно, реактивные свойства возбуждаемых рецепторных мембран в чувствующих клетках, специфических к раздражению солями, различны у этих двух органов.
Интересны процессы торможения в клетке, специфичной к раздражению водой (W-рецептор). Ответ рецептора максимален при действии дистиллированной воды. Добавление любого вещества, как имеющего тормозные свойства (октиламин), так и раздражителя для других рецепторов (сахароза, хлористый натрий), вызывает торможение водного рецептора, выражающееся в резком уменьшении частоты импульсов. Постепенное снижение концентрации водного раствора соли или сахара сопровождается повышением частоты импульсов водного рецептора.
Смеси растворов солей и Сахаров могут оказывать на контактные хеморецепторы и соответственно на пищевую реакцию либо возбуждающее, либо тормозящее действие в зависимости от соотношения компонентов в смеси. Тормозящее действие смеси растворов сахара и соли проявляется при любой концентрации взятых веществ в диапазоне от 0,01 до 1,0 М. Это хорошо заметно на примере контактных хеморецепторов комара Aedes aegypti. Если сравнить серии адаптационных кривых ответов S- и L-рецепторов при раздражении растворами сахарозы и хлористого калия, взятых раздельно, то обнаруживается зависимость ответа от их концентрации. Зависимость более четко выражена для L-рецептора и слабее для S-рецептора. Обращает на себя внимание то, что во всех случаях при раздражениях растворами эквимолярных концентраций сахарозы и хлористого калия частота импульсов S-рeцептора превышает частоту импульсов L-рецептора.
Раздражение лабеллярных сенсилл комара смесью растворов хлористого калия и сахарозы обычно вызывает уменьшение частоты импульсов для большинства концентраций. Это хорошо заметно для растворов хлористого калия всех концентраций в диапазоне от 0,05 до 1,0 М при сравнении частоты импульсов соответствующего рецептора в каждой концентрации с опытами, где раздражители использовались раздельно. Интересно, что смесь растворов сахарозы и хлористого калия эквимолярных (0,5 М) концентраций вызывает в хеморецепторных сенсиллах комаров афферентный залп, состоящий преимущественно из импульсов S-рецептора. Приблизительно одинаковое число импульсов S- и L-рецепторов в первые 200 мс после начала раздражения наблюдается при действии на сенсиллу смеси растворов 0,1 М сахарозы и 0,9 М хлористого калия.
Можно предположить три возможных объяснения эффекта торможения в смеси двух растворов. Во-первых, физико-химическое взаимодействие между молекулами соли и сахара перед их воздействием на рецепторную мембрану. Во-вторых, взаимодействие молекул сахара и соли на рецепторной мембране - "конкурентное" торможение. В-третьих, взаимодействие между S- и L-рецепторными клетками.
Статистической обработкой афферентных залпов импульсов было установлено, что возбуждение L-рецептора возникает независимо от раздражения S-рецептора и наоборот. Некоторые вещества не вызывают возбуждения этих рецепторов, но оказывают тормозящий эффект в смеси с раздражителем. Поэтому было высказано мнение, что тормозящий эффект в смеси раздражителей вызван изменениями коэффициентов диффузии и термодинамической активности компонентов в растворе.
Однако последние работы в этом направлении говорят о том, что тормозные эффекты при действии специфических ингибиторов (СаСl2, уксусная кислота, октиламин и др.) и ослабление реакции в ответ на раздражение смесью двух или более раздражающих компонентов связаны с процессами, происходящими в рецепторной мембране. Так как в рецепторной мембране предполагается наличие специфических участков, избирательно взаимодействующих с молекулами определенной формы, то в простейшем случае имеются два типа таких участков. Первый реагирует с молекулами, вызывающими возбуждение, что приводит к деполяризации мембраны, а второй - с молекулами, оказывающими тормозной эффект и приводящими к гиперполяризации мембраны. Взаимодействие возбудимых и тормозных специфических участков мембраны при действии многокомпонентных раздражителей, очевидно, обеспечивает тот или иной характер ответа, выраженный в виде афферентного залпа импульсов.
Специфичность чувствующих клеток у фитофагов
Своеобразие питания фитофагов определяет свойства рецепторных клеток. Среди жуков-листоедов рода Chrysolina один из видов считается монофагом зверобоя, богатого гликозидом гиперазидом. Исследование набора рецепторных клеток тарзальных сенсилл этого жука позволило выделить одну клетку, которая возбуждается только этим алкалоидом. Другие виды жуков Chrysolina, не являющиеся монофагами зверобоя, не имеют этого рецептора, хотя характеристики остальных чувствующих клеток в тарзальных сенсиллах совпадают.
Возбуждение тех или иных специфических клеток в контактных и обонятельных сенсиллах часто связывают со способностью насекомых дифференцировать пищевые субстраты, определять качество пищи. Так, активность сахарного и водного рецепторов мух обычно связывают с положительными пищевыми реакциями, а солевого - с отрицательными. Эта зависимость хорошо проявляется при действии на сенсиллы больших концентраций (0,5-1,0 М) сахара или соли. Специфичность рецепторов, однако, не абсолютна, и уменьшение концентрации раздражителя обычно приводит к тому, что в ответе участвуют две или три чувствующие клетки сенсиллы. К тому же отмечается значительная вариабельность контактных хеморецепторных сенсилл по набору рецепторов и возбудимости чувствующих клеток как при сравнении сенcилл, расположенных на различных участках лабеллума или тарзуса, так и при повторных раздражениях одной и той же сенсиллы каким-либо раздражителем. Анализируя ответы отдельных сенсилл, в которых возбуждены две или более клетки, некоторые авторы даже приходят к выводу, что специфичности индивидуальных клеток к конкретным химическим соединениям не существует, а информация кодируется по изменению частоты импульсов, поступающих по афферентным волокнам в центральную нервную систему.
Аналогичная картина наблюдается и при исследовании вкусовых сенсилл гусениц, где исследовались ответы максиллярных сенсилл монофагов и олигофагов на соки предпочитаемых и непредпочитаемых растений. В этих опытах не было обнаружено достоверной разницы в электрофизиологических ответах на соки растений, поедаемых или отвергаемых гусеницами.
Исследования характера специфичности вкусовых сенсилл гусениц чешуекрылых показали большое разнообразие как числа специфических чувствующих клеток в максиллярных стилоконических сенсиллах, так и химических соединений, многие из которых имеют сигнальное значение при узнавании гусеницами кормового растения (табл. 6).
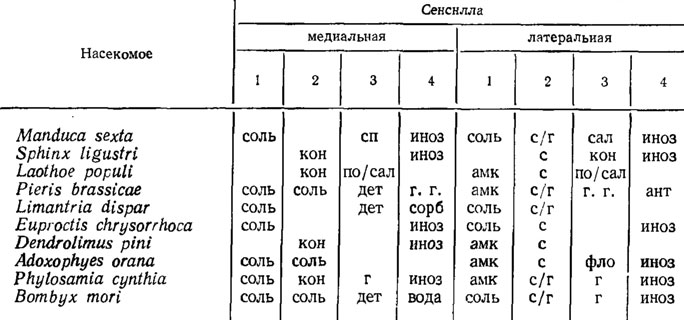
Таблица 6 Специфичность рецепторных клеток в максиллярных стилоконических сенсиллах у личинок различных насекомых (по Шоонховену, 1974). Обозначения: соль - избирательный ответ на соли; кон - на коннесин; сп - на спирт; по-на популни; сал - на салицил; дет - на детерренты; г - на глюкозу; иноз - на инозитол; г. г. - на горчичные глюкозиды; сорб - на сорбитол; амк - на аминокислоты; с - на сахарозу; ант - на антоциан.
Широкий набор специфических рецепторных клеток у гусениц отражает разнообразие пищевых субстратов и способность насекомых к переходу с одного растения на другое при питании. Это подтверждается экспериментально. Так, перевод гусениц бражника Manduca sexta на искусственную диету привел к изменению пищевых реакций, которое выражалось в том, что гусеницы стали поедать растения, ранее отвергаемые ими. Добавление салицила в диету этой гусеницы, питающейся на томате, позволило направленным воспитанием повысить чувствительность рецепторов к новому кормовому растению - капусте. Направленный сдвиг чувствительности рецепторов у гусениц можно получить в течение одной генерации. Однако чтобы путем направленного воспитания получить изменения в реактивности контактных рецепторов к различным концентрациям хлористого натрия у мух и комаров, требуется 8-10 поколений.
Личинки хлебного жука Anisoplia austriaca, обитающие в почве и питающиеся корнями злаков, ограничены в возможностях передвижения и выборе пищи по сравнению с гусеницами. Видимо, поэтому у них более четко проявляется разница в ответах контактных хеморецепторных сенсилл на предпочитаемые и отвергаемые растения (табл. 7).
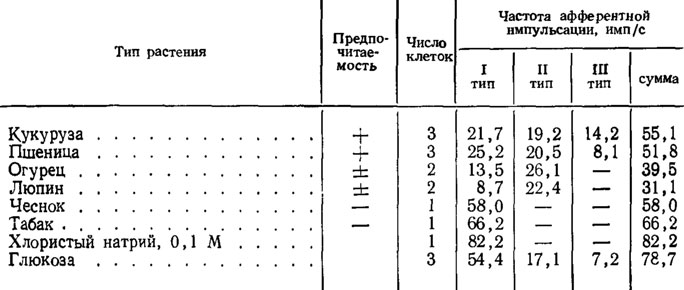
Таблица 7 Реакция стилоконической сенсиллы личинки хлебного жука на контактное раздражение соками растений (по Елизарову, Куэн, 1969)
В стилоконической сенсилле хлебного жука на раздражение глюкозой отвечают три чувствующие клетки, а на раздражение хлористым натрием - одна. Спектры ответов на водные экстракты корней различных растений напоминают ответы на соль и сахар, хотя частота импульсов имеет меньшие значения.
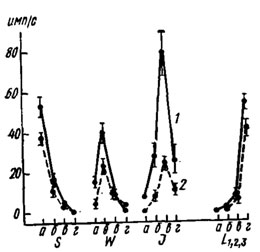
Рис. 31. Физиологические характеристики солевого (L1,2,3), сахарного (S) и промежуточных (W, J) рецепторов в лабеллярной сенсилле мухи Musca domestica. По оси ординат - импульсная активность чувствующих клеток сенсилл на стандартный набор раздражителей, имп/с: 0,2-молярнын раствор глюкозы (а); 0,01-, 0,1- и 1-молярные растворы NaCl (соответственно б, в, г). 1 - сенсиллы адорального ряда, 2 - аборального. Каждая кривая - среднее из 20 повторностей
Исследование индивидуальных характеристик нескольких десятков хеморецепторных волосков на лабеллуме мухи Musca domestica по типам ответов на стандартный набор раздражителей (сахара и соли) позволило выделить солевой, сахарный и два промежуточных рецептора (рис. 31). Следует отметить, что набор рецепторов в сенсиллах хоботка одной и той же мухи варьирует в значительной степени. Например, из четырех хеморецепторных клеток сенсиллы три могут иметь характеристики солевого рецептора, а одна - сахарного. Могут встречаться также волоски, где солевых рецепторов вообще нет.
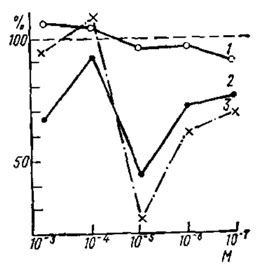
Рис. 32. Тормозной эффект действия оубаина в смеси с 0,1-молярным раствором хлористого натрия (по Грицай, 1975). По оси абсцисс - концентрация оубаина, М; по оси ординат - импульсная активность лабеллярной сенсиллы мухи Musca domestica в процентах от частоты импульсов при контрольном раздражении. Пунктир - ответ сенсиллы на контрольные раздражения 0,1 М раствором NaCl в каждой концентрации оубанна. 1 - интенсивность ответов солевого рецептора при раздражении смесью растворов оубаина и хлористого натрия; 2, 3 -? то же для промежуточного и сахарного рецепторов соответственно
Специфичность рецепторов в лабеллярных сенсиллах мухи Musca domestica подтверждают результаты экспериментов, где определялся эффект действия оубаина - ингибитора мембранной Nа+-К+-активируемой АТФ-азы. Система АТФ - Nа+-К+-активируемая АТФ-аза - одна из основных систем в комплексе процессов, обеспечивающих активный транспорт ионов через клеточные мембраны. Оказалось, что высокие концентрации оубаина (10-2М) вызывают необратимое подавление импульсной активности всех чувствующих клеток лабеллярной сенсиллы за 18-20 мин. Если же регистрировать ответы рецепторных клеток в первые 200 мс после нанесения раздражителя в смеси с различными концентрациями оубаина, то тормозной эффект оубаина проявляется лишь в концентрации 10-5М и неодинаково для различных рецепторных клеток в сенсилле. Сахарный рецептор снижает частоту импульсов в ответе на 75%, а промежуточный - на 55%. Действие оубаина на солевой рецептор не сопровождается тормозным эффектом (рис. 32).
Перфорация хеморецепторной сенсиллы непосредственно на кончике волоска позволяет подвергать воздействию оубаина в первые доли секунды только хеморецепторную мембрану периферического отростка чувствующей клетки - участка, где возникает генераторный потенциал. Место возникновения потенциалов действия- дендритный холмик - удалено от вершины волоока на 500 мкм. Раздражающий раствор может проникнуть к этому участку по внутренней полости волоска, но его концентрация в содержащейся в просветах жидкости должна сильно снизиться.
Именно этой особенностью строения хеморецепторной сенсиллы можно объяснить довольно высокие концентрации оубаина и длительное время, необходимое для подавления АТФ-азной активности в месте возникновения потенциала действия. Обращает на себя внимание тот факт, что при длительном действии оубаина все три рецептора прекращают работу приблизительно одновременно в зависимости от концентрации ингибитора. Этот факт позволяет предположить одинаковую АТФ-азную активность в зонах возникновения потенциалов действия для трех рецепторных клеток сенсиллы.
Использование микропипетки для регистрации импульсной активности лабеллярных хеморецепторов мухи позволило обнаружить тормозной эффект действия оубаина в первые 200 мс адекватного раздражения. Кратковременность этого процесса позволяет сказать, что полученный эффект связан с действием оубаина на хеморецепторную мембрану, находящуюся непосредственно под перфорацией волоска. Очевидно, хеморецепторные мембраны солевого, сахарного и промежуточного рецепторов обладают различной чувствительностью к оубаину и, следовательно, различной ферментативной активностью.
|
ПОИСК:
|
© INSECTALIB.RU, 2010-2019
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://insectalib.ru/ 'Насекомые - библиотека по энтомологии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://insectalib.ru/ 'Насекомые - библиотека по энтомологии'